Il microbiota intestinale non ha soltanto un’importanza nella fisiologia locale dell’intestino, ma entra anche in gioco nelle più complesse connessioni neuro-endocrine tra intestino e cervello, legate anche al sistema emozionale e alla reazione da stess (Marucci & Dalla Ragione, 2016). Il microbiota intestinale è collegato al sistema nervoso attraverso l’asse intestino-cervello (Gut-brain axis). Si tratta di un sistema di comunicazione bidirezionale (De Vadder et al., 2014) tra l’intestino e il cervello regolato da sistemi neuronali, endocrini e immunologici (Collins et al., 2012). Numerosi meccanismi sono stati proposti per spiegare come il microbiota intestinale potrebbe influenzare il cervello e apportare cambiamenti sul comportamento.
Il nervo vago, X nervo del cranio, rappresenta un mezzo di comunicazione diretto tra intestino-cervello (Cussottoa et al.,2018).
E’ fondamentale ricordare che nell’intestino è presente il sistema nervoso enterico (ENS) o “secondo cervello” che comunica con il sistema nervoso centrale (SNC), creando segnali neurochimici diretti dal microbiota intestinale al cervello e dal sistema nervoso al microbiota intestinale (Sampson T.R. & Mazmanian SK, 2015).
I microrganismi che si trovano nell’intestino producono neurotrasmettitori che possono influenzare il comportamento. La serotonina è uno dei principali neurotrasmettitori presenti nel cervello, nonostante il 90% venga prodotta nell’intestino con la collaborazione di Enterococcus e Streptococcus (Roubalovà et al., 2019).
Il batterio Bifidobacterium infantis modula i livelli di serotonina attraverso l’aumento o diminuzione del triptofano (Roubalovà et al., 2019), precursore della serotonina.
La Dopamina, viene prodotta nel tratto gastrointestinale da batteri di genere Bacillus (Roubalovà et al., 2019) ed è fondamentale nel circuito della ricompensa.
Nell’intestino avviene anche la produzione di acidi grassi a corta catena (SCFA).
Gli SCFA sono i prodotti della fermentazione batterica nel colon e il 95% di queste molecole è costituito da butirrato, proprionato e acetato. Il butirrato è fonte di energia per i colonociti, il proprionato è principalmente usato dagli epatociti e l’acetato invece entra principalmente negli epatociti e nel circolo sanguigno (Dalile et al., 2019). Gli SCFA possono comunicare con il cervello attraverso il nervo vago, oppure attraverso altre vie.
Gli SCFA possono alterare il comportamento in quanto hanno un’elevata affinità ai recettori accoppiati alle proteine G. Essi infatti regolano: il metabolismo energetico, l’omeostasi intestinale e la risposta immunitaria (Caspani et al., 2019)
Lo stress può indurre un cambiamento del microbiota intestinale attraverso l’asse ipotalamo-ipofisi-surrene (HPA). In presenza di uno stimolo esterno l’ipotalamo produce il fattore di rilascio della corticotropina (CRH). Questo stimola la produzione dell’ormone adrenocorticotropo (ACTH) da parte dell’ipofisi. L’ACTH stimola la sintesi di ormoni glucocorticoidi da parte del surrene (Roubalovà et al., 2019). Il cortisolo è il principale ormone glucocorticoide.
In conclusione il microbiota intestinale agisce attraverso la produzione diretta di metaboliti (SCFA, neurotrasmettitori e precursori di composti neuroattivi), e, indirettamente con la secrezione di ormoni.
Un funzionamento alterato di queste interazioni può indurre ansia, depressione e una modifica del comportamento alimentare frequente in molte patologie psichiatriche come l’anoressia nervosa (Kaye et al., 2004).
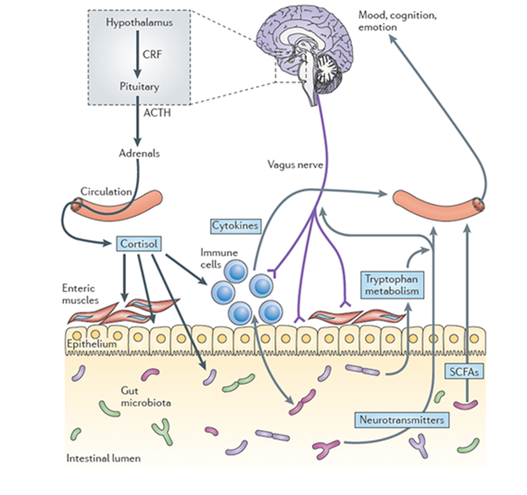
Percorsi coinvolti nella comunicazione bidirezionale tra il microbiota intestinale e il cervello ( Bryon Petschow et al., 2013).
BIBLIOGRAFIA
- Marucci & Dalla Ragione – L’anima ha bisogno di un luogo, 2016
- De Vadder F, Kovatcheva-Datchary P, Goncalves D, Vinera J, Zitoun C, Duchampt A, Bäckhed F, Mithieux G. – Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits. Cell. 2014 Jan 16;156(1-2): 84-96
- Collins SM, Surette M, Bercik P – The interplay between the intestinal microbiota and the brain. Nat Rev Microbiol. 2012 Nov;10(11):735-42
- Cussotto S, Sandhu KV, Dinan TG, Cryan JF-The Neuroendocrinology of the Microbiota-Gut-Brain Axis: A Behavioural Perspective – Front Neuroendocrinol. 2018 Oct;51:80-101.
- Sampson TR, Mazmanian SK – Control of brain development, function, and behavior by the microbiome – Cell Host Microbe. 2015 May 13;17(5):565-76
- Roubalová R , Procházková P , Papežová H , Smitka K , Bilej M , Tlaskalová-Hogenová H – Anorexia nervosa: Gut microbiota-immune-brain interactions- Clin Nutr. 2019 Mar 23. pii: S0261-5614(19)30137-2
- Dalile B, Van Oudenhove L, Vervliet B, Verbeke K.- The role of short-chain fatty acids in microbiota-gut-brain communication – Nat Rev Gastroenterol Hepatol. 2019 Aug;16(8):461-478
- Caspani G., Sidney Kennedy, Jane A. Foster, and Jonathan Swann – Gut microbial metabolites in depression: understanding the biochemical mechanisms – Microb Cell. 2019 Oct 7; 6(10): 454–481
- Kaye WH , Bulik CM , Thornton L , Barbarich N , Masters K – Comorbidity of anxiety disorders with anorexia and bulimia nervosa.- Am J Psychiatry. 2004 Dec;161(12):2215-21
- Bryon Petschow, Joël Doré, Patricia Hibberd, et. al – Probiotics, prebiotics, and the host microbiome: the science of translation- Ann N Y Acad Sci. 2013 Dec; 1306(1): 1–17


